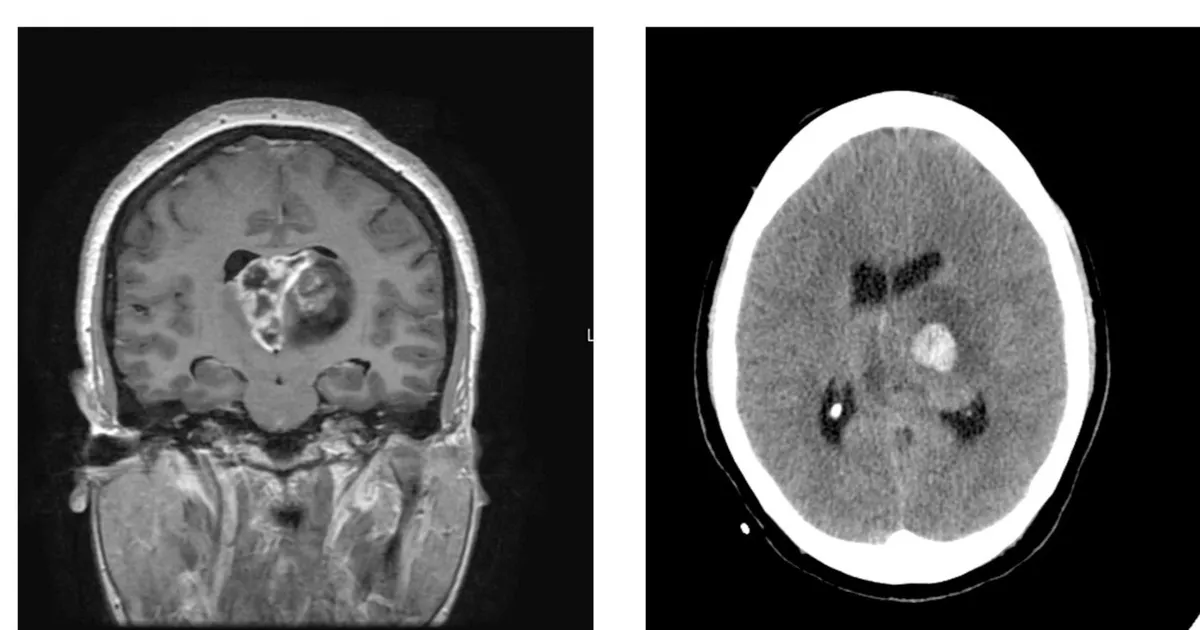
أعلن فريق علماء اكتشاف آلية جديدة تفسر كيف ينشأ واحد من أخطر أنواع سرطانات الدماغ؛ هو الورم الدبقي الأرومي.
وأفادت الدراسة، التي أجراها باحثون في جامعتي كوين ماري البريطانية، وستانفورد الأميركية، ونشرتها دورية "Cancer Discovery"، بأن حلقات من الحمض النووي خارج الكروموسومات – تُعرف باسم ecDNA – تظهر في المراحل المبكرة جدًا من المرض، بل أحيانًا قبل تشكل الورم نفسه.
وتحمل هذه الحلقات "المتمردة" جينات مسرطنة توفر للورم قدرة استثنائية على النمو السريع، والتكيف مع الظروف، ومقاومة العلاج، ما يجعلها هدفاً واعداً للكشف المبكر وربما للعلاج.
ولم يعد عالم المادة الوراثية مقتصراً على الكروموسومات المعروفة، لأن العلماء بدأوا في السنوات الأخيرة تسليط الضوء على مكونات جينية أخرى كانت مهملة لوقت طويل؛ وهي حلقات الحمض النووي خارج الكروموسومات وهي عبارة عن قطع دائرية من الحمض النووي تعيش داخل نواة الخلية لكنها مستقلة تماماً عن الكروموسومات الرئيسية.
واكتشف العلماء هذه الحلقات منذ عقود، لكن لسنوات طويلة اعتقدوا أنها مجرد بقايا دون وظيفة تشبه "القمامة الجينية"، لكن مع تطور تقنيات تحليل الجينوم، تبين أن هذه الحلقات تلعب أدواراً محورية، خاصة في الخلايا السرطانية.
وفي حين توجد هذه الحلقات بكميات محدودة في الخلايا الطبيعية، يزداد عددها بشكل كبير في الأورام، لكن الأخطر من ذلك أنها قادرة على حمل جينات مسرطنة أو جينات تمنح الخلايا مقاومة للأدوية.
ولأنها خارج الكروموسومات، فهي تتضاعف وتوزع نفسها بطرق غير متوقعة أثناء انقسام الخلية، ما يؤدي إلى تنوع جيني داخل الورم يمنحه مرونة وقوة في مواجهة العلاجات.
وتظهر أهمية الحمض النووي خارج الكروموسومات في السرطان بوضوح؛ إذ كشفت دراسات حديثة أن نحو 40% من الأورام الصلبة، مثل أورام الدماغ والرئة والمعدة، تحتوي على هذه الحلقات.
ويتسبب وجود هذه الحلقات في جعل الورم أكثر عدوانية، ورفع نشاط الجينات المسرطنة لمستويات أعلى بكثير من الطبيعي، وهو ما يفسر لماذا تفشل بعض العلاجات الكيميائية أو الموجهة، لأن الأورام المزودة بـ"ذخيرة جينية متنقلة" تستطيع التحايل على محاولات القضاء عليها.
وحتى الآن، لا توجد أدوية تستهدف هذا الحمض بشكل مباشر، لكن الأبحاث مستمرة لفهم كيفية تكوينها وكيف يمكن وقف تضاعفها.
ويرى بعض العلماء أن تعطيل الآليات التي تسمح لهذه الحلقات بالتكاثر ربما يفتح الباب أمام جيل جديد من العلاج، وإذا تحقق ذلك، فقد يغير مسار التعامل مع أنواع من السرطان كان يُنظر إليها في السابق على أنها شبه مستعصية.
دمج البيانات
ويعد الورم الدبقي الأرومي من أكثر السرطانات عدوانية، إذ لا يتجاوز متوسط البقاء على قيد الحياة بعد التشخيص 14 شهراً، ولم يتحقق أي تقدم كبير في علاجه منذ عقود.
ومع محدودية الأدوية والخيارات المتاحة، يبحث العلماء عن طرق مبتكرة لفهم جذور المرض والتعامل معه من البداية.
اعتمد فريق البحث، على دمج بيانات جينية وصورية من أورام مرضى مع نماذج حاسوبية متقدمة تحاكي تطور الحمض النووي خارج الكروموسومات عبر الزمن والمكان.
ما هو الورم الأرومي الدبقي؟
نوع من السرطان يبدأ في الدماغ أو الحبل النخاعي.
يتكون من خلايا تُسمى "الخلايا النجمية" التي تدعم الخلايا العصبية.
ينمو بسرعة وقد يغزو الأنسجة السليمة ويدمرها.
يمكن أن يصيب أي عمر، لكنه أكثر شيوعًا لدى البالغين الأكبر سنًا.
لا يوجد علاج شافٍ حتى الآن، لكن العلاجات تساعد على إبطاء النمو وتخفيف الأعراض.
الأعراض
صداع يزداد سوءًا، خصوصًا في الصباح.
غثيان وقيء.
اضطرابات في التفكير أو الفهم أو فقدان الذاكرة.
تغيّرات في الشخصية أو سهولة الاستثارة.
تغيّرات في الرؤية، تَغَيُّم، ازدواج، فقدان الرؤية المحيطية.
صعوبة في الكلام.
مشكلات في التوازن أو التناسق.
ضعف في عضلات الوجه أو الأطراف.
ضعف حاسة اللمس.
نوبات صرع، خصوصًا عند من لم يصابوا بها من قبل.
متى يجب زيارة الطبيب
عند ظهور أي من الأعراض السابقة بشكل متكرر.
الأسباب
السبب الدقيق غير معروف.
يحدث نتيجة تغيرات في الحمض النووي لخلايا الدماغ أو الحبل النخاعي.
هذه التغيرات (طفرات) تعطي أوامر للخلايا بالانقسام السريع وعدم الموت في الوقت المناسب.
يؤدي ذلك إلى تراكم الخلايا وتشكيل ورم يضغط على الأعصاب وأجزاء الدماغ أو يغزو الأنسجة السليمة.
وقال المؤلف المشارك في الدراسة، بنجامين فيرنر، من معهد بارتس للسرطان بجامعة كوين ماري: "تعاملنا مع الأورام كما يفعل عالم الآثار؛ لم نأخذ عينة واحدة فقط، بل حللنا عدة مناطق من الورم، وبنينا نماذج تصف كيف نشأت هذه الحلقات وتطورت لتقود عدوانية الورم".
وأظهرت النتائج أن أغلب هذه الحلقات تحتوي على جين مستقبل عامل نمو البشرة المعروف باسم EGFR، وهو من أقوى الجينات المسرطنة، لكن الأخطر هو أنها ربما تظهر قبل تكون الورم، ثم تطور طفرات إضافية مثل EGFRvIII تزيد من شراسة السرطان ومقاومته للعلاج.
وجين EGFR هو أحد البروتينات الغشائية الأكثر دراسة في عالم البيولوجيا الطبية، نظراً لدوره الحاسم في نمو الخلايا وبقائها ويوجد على سطح العديد من أنواع الخلايا، وعندما يرتبط به جزيء "عامل نمو البشرة" أو جزيئات مشابهة، يقوم بتنشيط سلسلة معقدة من الإشارات داخل الخلية تُعرف باسم "مسار إشارات التيروزين كيناز".
وتحفز هذه الإشارات انقسام الخلايا، وإصلاح أنسجتها، وتنظيم موتها المبرمج عند الحاجة، لكن المشكلة تبدأ عندما يحدث خلل في ذلك المستقبل، سواء عبر طفرات جينية أو زيادة مفرطة في عدد النسخ الجينية أو نشاطه بشكل غير طبيعي.
في مثل هذه الحالات، يصبح المستقبل مصدرًا لإشارات نمو مستمرة تدفع الخلية للانقسام دون توقف، وهو ما يُعد سمة أساسية للسرطان، وبالفعل جرى رصد طفرات في جين EGFR في سرطانات الرئة ذات الخلايا غير الصغيرة، وبعض أورام الدماغ مثل الورم الأرومي الدبقي، إضافة إلى سرطانات القولون والثدي.
وقادت هذه الاكتشافات إلى تطوير فئة جديدة من الأدوية تُعرف بالمثبطات الموجهة لـ EGFR، مثل الأجسام المضادة وحيدة النسيلة، التي أحدثت ثورة في علاج بعض أنواع السرطان عبر استهداف الخلل الجزيئي بدقة.
ومع ذلك، فإن فعالية هذه العلاجات ربما تتضاءل بمرور الوقت بسبب تطور مقاومة لدى الخلايا السرطانية، ما يجعل EGFR موضوعًا مفتوحًا للبحث المستمر لفهم آلياته بشكل أعمق وتطوير استراتيجيات أكثر تقدمًا للسيطرة عليه.
ويرى المؤلف المشارك في الدراسة، ماجنوس هوجي، أن ظهور جينات مستقبل عامل نمو البشرة في الحمض النووي خارج الكروموسومات يخلق "نافذة زمنية" يمكن خلالها رصد المرض والتدخل قبل أن يصبح الورم أكثر عدوانية.
ليس مجرد راكب
إذا نجح العلماء في تطوير اختبار دم لاكتشاف هذه الحلقات مبكراً، فقد يفتح ذلك الباب لتشخيص مبكر وعلاج أكثر فاعلية.
وأوضحت الدراسة أن حلقات الحمض النووي خارج الكروموسومات لا تحمل جيناً واحداً فقط، بل قد تحتوي على عدة جينات سرطانية، كل منها يساهم بطريقته في تطور الورم واستجابته للعلاج وهو ما يسلط الضوء على أهمية تصميم علاجات شخصية تستند إلى "بروفايل" الحمض النووي حارج الكروموسومات الخاص بكل مريض.
ورغم هذا التقدم، لا يزال الكثير غير معروف عن دور ذلك الحمض؛ ويخطط الباحثون لدراسة تأثير العلاجات المختلفة على أعداد وأنواع هذه الحلقات في أورام الدماغ، كما يعتزمون توسيع الأبحاث لتشمل أنواع سرطانية أخرى.
وقال المؤلف المشارك في الدراسة، تشارلي سوانتون، إن النتائج تشير إلى أن الحمض النووي خارج الكروموسومات ليس مجرد راكب في رحلة السرطان "بل سائق قوي منذ المراحل الأولى، وهذا يفتح المجال للكشف المبكر والتدخل قبل أن يصبح الورم مقاومًا للعلاج".
وأوضح المؤلف المشارك في الدراسة، بول ميشيل، الباحث في جامعة ستانفورد، أن "هذه النتائج تقدم رؤية جديدة عن كيفية نشوء وتطور الأورام، وربما نكون أمام فرصة لجعل الورم الأرومي الدبقي ضمن السرطانات التي يمكن اكتشافها والتدخل فيها مبكرًا".
لقراءة المقال بالكامل، يرجى الضغط على زر "إقرأ على الموقع الرسمي" أدناه